La adrenalina
 La adrenalina, también conocida como epinefrina por su Denominación Común Internacional (DCI), es una hormona y un neurotransmisor. Incrementa la frecuencia cardíaca, contrae los vasos sanguíneos, dilata los conductos de aire, y participa en la reacción de lucha o huida del sistema nervioso simpático. Químicamente, la adrenalina es una catecolamina, una monoamina producida sólo por las glándulas suprarrenalesa partir de los aminoácidos fenilalanina y tirosina.
La adrenalina, también conocida como epinefrina por su Denominación Común Internacional (DCI), es una hormona y un neurotransmisor. Incrementa la frecuencia cardíaca, contrae los vasos sanguíneos, dilata los conductos de aire, y participa en la reacción de lucha o huida del sistema nervioso simpático. Químicamente, la adrenalina es una catecolamina, una monoamina producida sólo por las glándulas suprarrenalesa partir de los aminoácidos fenilalanina y tirosina.
El término adrenalina se deriva de las raíces latinas ad- y renes que literalmente significa "junto al riñón", en referencia a la ubicación anatómica de la glándula suprarrenal en el riñón. Las raíces griegas epi y nephros tienen un significado similar, "sobre el riñón", y dan origen a epinefrina. El término epinefrina es usualmente abreviado a epi en la jerga médica.
Los extractos suprarrenales conteniendo adrenalina se obtuvieron por primera vez por el fisiólogo polaco Napoleon Cybulski en 1895. Estos extractos, que él llamó nadnerczyna, contenían epinefrina y otras catecolaminas. El químico japonés Jokichi Takamine y su asistente Keizo Uenaka descubrieron independientemente la adrenalina en 1900. En 1901, Takamine aisló y purificó con éxito la hormona de las glándulas suprarrenales de ovejas y bueyes. La adrenalina fue por primera vez sintetizada en un laboratorio por Friedrich Stolz y Henry Drysdale Dakin, de forma independiente, en 1904.
La adrenalina es una hormona y neurotransmisor producido por las glándulas suprarrenales. La denominación común internacional (DCI) es epinefrina, término mucho más utilizado en el ámbito médico. Esta hormona se produce especialmente en situaciones de estrés, excitación o nerviosismo. Sus poderosos efectos son parte de la respuesta del organismo ante el peligro. Entre sus principales efectos está el aumento del ritmo cardíaco, contracción de los vasos sanguíneos y dilatación de las vías respiratorias; todos encaminados a un aumento del flujo sanguíneo hacia los músculos y de oxígeno a los pulmones. La adrenalina se utiliza cómo tratamiento en algunos casos de alto riesgo para la vida como shock anafiláctico o paro cardíaco.
Balanceo ecuaciones químicas😃
En una ecuación química, el número de átomos de cada elemento en los reactantes debe ser igual al número de átomos de cada elemento en los productos. A este tipo de ecuación se le conoce como ecuación química equilibrada.
Si se presenta el caso de que el número de átomos no es igual, la ecuación se debe equilibrar o balancear.
Para balancear una ecuación química podemos usar los siguientes métodos:
- Método de tanteo
- Método algebraico
Método de tanteo
Para balancear utilizando este método, debemos anteponer números enteros (coeficientes estequiométrico) que permitan la mínima igualdad de átomos en reactantes y en productos.
Ejemplo1:
CH4(g) + O2(g) → CO2(g) + H2O(l)
Paso 1- Determina la cantidad de átomos de cada elemento presente tanto en los reactantes como en losproductos. Lo que debes hacer es sumar los átomos del elemento presentes en cada caso para encontrar su número total. Entonces, tenemos:

Como los átomos de los elementos no son iguales en los reactantes ni en los productos, hay que balancear la ecuación.
Paso 2- Realiza el balanceo de la ecuación.
Para ello, te sugerimos tomar como referencia la sustancia que tiene mayor número de átomos y, según ella, asignar los coeficientes. En este caso es el CH4: 1 átomo de carbono y 4 de hidrógeno = 5 átomos en total. Como el coeficiente de esta molécula es 1, se considera 1 el coeficiente de la molécula que contenga carbono en los productos, es decir, el CO2.
Entonces, quedaría así: CH4 + O2 → 1CO2 + H2O.
Paso 3- Completa el balanceo.
Sigue con el segundo elemento en la molécula de CH4, el hidrógeno. Como tiene 4 átomos, se debe igualar en cantidad en los productos; en este caso, con el H2O. Si le anteponemos un 2 a la molécula de agua se igualarían los hidrógenos: CH4 + O2 → 1CO2 + 2H2O.
Paso 4- Revisa los coeficientes en los productos para completar los elementos que falten.
En este caso, no están igualados los oxígenos. Si sumas los átomos de oxígeno que hay en los productos son 4, y en los reactantes solo hay 2.
Por ende, debes colocar un coeficiente antes del O2 : 1CH4 + 2O2 → 1CO2 + 2H2O.
Paso 5- Comprueba que los coeficientes asignados sean correctos y balanceen la ecuación.
Finalmente, podemos decir que los coeficientes estequiométricos de la ecuación son 1, 2, 1 y 2, con los que obtenemos 1 átomo de carbono, 4 de hidrógeno y 4 de oxígeno tanto en los reactantes como en los productos.
Ejemplo2:
K Cl O3 → K Cl + O2

- Podemos ver que la reacción no tiene los mismos átomos de O, por lo que debemos balancear la ecuación.
- Para resolver la ecuación multiplicamos por 2 al lado de los reactantes y por 3 el oxígeno en el lado de los productos.
Quedaría así: 2K Cl O3 → K Cl + 3O2
Ahora tenemos el problema que los átomos de K y Cl quedan desbalanceadas por lo que deberemos multiplicar por 2 al lado de los productos.
Quedaría así:
2K Cl O3 → 2 K Cl + 3O2
| Elemento | Reactante | Producto |
| K | 2 • 1 = 2 | 2 • 1 = 2 |
| Cl | 2 • 1 = 2 | 2 • 1 = 2 |
| O | 2 • 3 = 6 | 3 • 2 = 6 |
Método algebraico
También denominado método de coeficientes indeterminados, se lo emplea para balancear ecuaciones algo complicadas y se vale de procedimientos matemáticos de ajuste que tienen siempre como referencia la Ley de la conservación de la masa.
Recuerda que una ecuación química , es una igualdad del tipo:
A + B → C + D
Donde A y B representan las fórmulas ( o símbolos) de los reactantes, en tanto C y D corresponden a las de los productos.
Ejercicio resuelto:
C6H6 + O2 → CO2 + H2O
Para equilibrar esta ecuación necesitamos colocar ciertos números o coeficientes, delante de cada fórmula, de tal manera que el número de átomos de los reactantes y de los productos queden igualados; como no se conocen estos coeficientes, los reemplazamos por letras (a, b, c, d, etc.) quedando la ecuación:
aC6H6 + bO2 → cCO2 +d H2O
1°- Los átomos de carbono en el reactante son:6a
Los átomos de carbono en el producto son c, es decir: 6a=c
2°Los átomos del oxígeno son:
Reactante: 2b
Producto: 2c +d
Luego: 2b = 2c + d
3° Los átomos de hidrógeno son:
Reactante: 6a
Producto: 2d
Luego: 6a = 2d
De aquí se desprende que: d= 3a
4° Reemplazando en la ecuación del paso 2 el valor de c de la ecuación del paso 1( 6a=c) se tiene:
2b = 2 (6a) + d
2b = 12a + d
Pero sabemos también que d es igual a 3a, por lo que nos queda:
2b = 12a + 3a
2b = 15a
5° Ahora asigna un valor arbitrario a una de las incógnitas y resuelve el resto de las ecuaciones.
Por ejemplo, a sería igual a 1.
- Reemplazamos el valor de a en la ecuación del paso 1 y queda:
c= 6
- Reemplazamos el valor a en la ecuación del paso 4 y finalmente queda:
2b = 15 (1)
b = 15 / 2
6°Ahora podemos rremplazar los valores en la ecuación inicial:
aC6H6 + bO2 → cCO2 + d H2O
Quedaría:
1C6H6 + 15/2 O2 → 6CO2 + 3 H2O
- Como es preferible que los coeficientes sean números enteros, elimina los denominadores mutiplicando (amplificando) por 2 todos los valores (a, b, c, d):
2C6H6 + 15O2 → 12CO2 + 6 H2O
metodo redox
Una reacción de óxido-reducción no es otra cosa que una pérdida y ganancia de electrones, es decir, desprendimiento o absorción de energía (presencia de luz, calor electricidad, etc.) En una reacción si un elemento se oxida, también debe de existir un elemento que se reduce.
OXIDACIÓN: es cuando un elemento pierde electrones originando que aumente su estado de oxidación.
REDUCCIÓN: es cuando un elemento gana electrones, originando que disminuya su número de oxidación.
Por ejemplo: Un cambio de numero de oxidación de +1 a +4 o de -2 a 0 es oxidación. Una cambio de +4 a +1 o de -1 a -3 es reducción.

En una reacción de redox el agente oxidante acepta electrones ( es el que se reduce) y el agente reductor suministra electrones (es el que se oxida).
Para poder balancear por método de redox es importante recordar como determinar la cantidad de átomos de un elemento en un compuesto, así como determinar la cantidad de número de oxidación de cada elemento y conocer los pasos del método de redox.
PROCEDIMIENTO PARA EL MÉTODO DE REDOX
1.- Verificar que la ecuación este bien escrita y completa.
2.- Colocar los números de oxidación en cada uno de los elementos.
3.- Observar que números de oxidación cambiaron (un elemento se oxida y uno se reduce).
4.- Escribir la diferencia de números de oxidación de un mismo elemento.
5.- Multiplicar la diferencia de números de oxidación por los subíndices correspondientes de cada elemento.
6.- Cruzar los resultados
7..- Colocar los resultados como coeficientes en el lugar correspondiente.
8.-Completar el balanceo por tanteo.
9.- Verifica la cantidad de átomos en cada miembro de la ecuación.
10.-En caso de que todos los coeficientes sean divisibles se reducen a su mínima expresión.
EJEMPLO:
1.- Verificar que la ecuación este bien escrita y completa.
2.- Colocar los núumeros de oxidación en cada uno de los elementos.

3.- Observar que números de oxidación cambiaron (un elemento se oxida y uno se reduce).

4.- Escribir la diferencia de números de oxidación de un mismo elemento.

5.- Multiplicar la diferencia de números de oxidación por los subíndices correspondientes de cada elemento.

6.- Cruzar los resultados

7..- Colocar los resultados como coeficientes en el lugar correspondiente.

8.-Completar el balanceo por tanteo.

9.- Verifica la cantidad de átomos en cada miembro de la ecuación.

10.-En caso de que todos los coeficientes sean divisibles se reducen a su mínima expresión. (En este caso no son divisibles y quedan de la siguiente manera:)

Definición de mol.
El mol no es ninguna abreviatura. Mol es una unidad que está relacionada con la cantidad de sustancia que tenemos (átomos, moléculas, partículas en general).
Cuando decimos que tenemos un mol nos referimos a que tenemos una cantidad determinada de partículas. La cantidad de partículas contenidas en un mol viene dada por el número de Avogadro (NA = 6,022 · 1023) (primera definición). Por tanto, tener un mol de agua sería tener el número de Avogadro de moléculas de agua, es decir, tener
602.2003000.0002000.0001000.000 moléculas de agua.
Aunque el concepto de mol resulte extraño tiene una particularidad muy interesante: la masa de un mol de cualquier sustancia es numéricamente igual a su masa molecular (o atómica para los átomos) expresada en gramos (segunda definición), es la denominada masa molar. Así, continuando con el ejemplo del agua, la masa molecular del agua es 18 u, la masa de un mol (del número de moléculas indicado antes) es de 18 g.
Veamos qué significa:
En un vaso de agua tenemos alrededor de unos 200 ml de capacidad; es decir, caben unos 200 g de agua, alrededor de 11 moles (11 moles tienen una masa de 11 · 18 = 198 g), hay 11 veces el número de Avogadro de moléculas de agua. Cuando tomas un vaso de agua te estás bebiendo
64624.2003000.0002000.0001000.000 moléculas de agua.
Cálculos de moles.
Lo primero es conocer la masa atómica (si se trata de átomos) o masa molecular (si se trata de compuestos).
Los cálculos los haremos utilizando el factor de conversión, igual que si cambiáramos de unidad.
¿Cuántos moles tenemos en m gramos de un compuesto? Aplicaremos siguiente factor de conversión:

como m viene en gramos, en el denominador del factor pondremos la masa molecular en gramos, para que se vaya, y en el numerador 1 mol.
Ejemplo. Tengamos 225 g de agua, ¿cuántos moles son? Necesitamos la masa molecular del agua (Magua= 18 u):
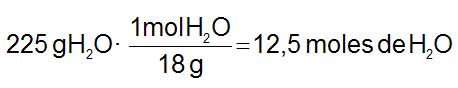
¿Cuántos gramos son n moles de un compuesto? Aplicaremos el siguiente factor de conversión:
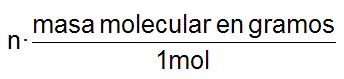
como n es el número de moles, en el denominador del factor pondremos 1mol y en el numerador la masa de un mol en gramos (masa molecular en gramos).
Ejemplo. Tengamos 15 moles de agua, ¿cuántos gramos son? Necesitamos la masa molecular del agua (Magua= 18 u):
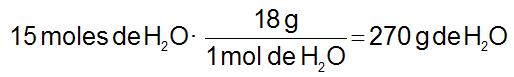

n Buscada: KClO3
n Conocida: O2
n: 6 moles O2

2.¿Cuantos moles de Cloro molecular se necesitan para producir 1,74 moles de Dicloruro de Diazufre?

n Buscada: Cl2
n Conocida: S2Cl2
n: 1,74 moles S2Cl2

3. ¿Cuantos moles de tricloruro de fosforo se necesitan para producir 0.52 moles de ácido clorhídrico?

n Buscada: PCl3
n Conocida: HCl
n: 052 moles Hcl

4. ¿Cuantos moles de Cloro molecular se necesitan para hacer reaccionar 4 moles de Dicloruro de hierro?

n Buscada: Cl2
n Conocida: FeCl2
n: 4 moles FeCl2

5. ¿Cuantos moles de Oxígeno molecular se necesitan para producir 7 moles de Óxido de Magnecio?

n Buscada: O2
n Conocida: MgO
n: 7 moles MgO
 Formula de la adrenalina
Formula de la adrenalina
C9H13NO3
Calculos
no se puede calcular las moles por que no hay un producto a la
ecuacion inicial
no se puede balancear por que no hay producto a la ecuacion inicial
no se puede balancear por que no hay producto a la ecuacion inicial
Opinion
yo creo que pues son temas faciles pero con un grado de
complicidad en algunas cosas, balancear ecuaciones determina el
numero de atomos totales en la ecuacion inicial y en su producto
No hay comentarios:
Publicar un comentario